De snakkes gjerne om to overlappende hovedårsaker til insulinresistens på cellenivå. Den ene av disse er en slags fettforgiftning/ opphopning av fett (fat overload) i vevene. Hovedgrunnen til denne opphopning en av fett antas å være høye nivåer av frie fettsyrer. Det er vanlig at overvektige har høye nivåer av frie fettsyrer i blodet, og de fleste med insulinresistens er også overvektige.
Frie fettsyrer er fett som skilles ut fra fettvev og som er klart til bruk; dette er fett som er klart til å forbrennes som energi. Et høyt nivå av frie fettsyrer regnes ofte som et tegn på at fettvevet er insulinresistent, ettersom insulin hindrer utskilling av frie fettsyrer og stimulerer fettvev til lagring. Fettvevet skal gi fra seg fett når det er lite mat tilgjengelig (mellom måltider) og det skal spare på fettet når det er nok mat tilgjengelig.
Om fettvevet blir insulinresistent, reagerer det ikke som det skal ved å holde igjen på fettet når insulinnivået er høyt. Det gir i stedet fra seg energi til tross for at det også kommer energi inn i blodet fra mat. Frie fettsyrer skal egentlig fraktes til vev og forbrennes, men om man har spist mye karbohydrater og beveget seg lite vil kroppens vev først og fremst forsøke å forbrenne karbohydrater. Derfor blir fettsyrene i stedet fraktet fra fettvevet og inn i andre vev der restprodukter (ceramider og diacylglyseroler) vil forstyrre insulinsignaliseringen i disse cellene.
Insulinresistente mennesker, eller dem med metabolsk syndrom, har en stor lagring av fett i kroppsvev som egenlig ikke skal ha så mye fett i seg. For eksempel kan man se mye intramuskulært fett, noe som antas å kunne gjøre musklene insulinresistente. Også bukspyttkjertelen kan fylles opp med fett på denne måten og kan gjøre at cellene der slutter å fungere eller til og med dør. Dette er en del av utviklingen av diabetes type 2.
Fettlever (steatose), en sykdom som tidligere kun var vanlig å se hos alkoholikere, er nå en helt vanlig diagnose og opptrer ganske konsekvent sammen med insulinresistens. Tilstanden kalles nå NAFLD (Non-Alcoholic Fatty Liver Disease). Ved NAFLD fylles leveren med fett som en menneskelig foie gras. Fugler har en stor kapasitet til å lagre fett i lever fordi fettet brukes som energi på lengre turer. Hos mennesker skal fett først og fremst lagres i fettvev. Fettet i leveren kommer fra tre steder: fra opptak av mat, fra leverens egenproduksjon av fett, eller fra fettvevet. Det ser ut til at hovedproblemet er fettet som blir produsert i leveren sammen med fettet som sendes ut fra fettvevet. Når leveren lager fett (de novo lipogenese), lager den det av karbohydrater. Fett fra maten, som tas opp og fraktes til leveren, vil ikke være noe problem om ikke leveren samtidig blir presset til å gjøre om karbohydrater til fett og fikk tilsendt mye fett fra fettvevet [1]. Overskudd av karbohydrater og spesielt fruktose gjøres om til fett i leveren før det sendes til fettvevet for lagring. Fruktose er antatt å bidra spesielt mye til NAFLD. Fettet fra fettvevet ville heller ikke vært noe problem om vi bare forbrant det som energi, blant annet i musklene. Men, som sagt, om maten i hovedsak består av karbohydrater vil karbohydrater forbrennes til fordel for fett. Donnelly og kolleger fant at 59% av fettet i leveren stammer fra frie fettsyrer, som i hovedsak kommer fra fettvevet, mens ca 26% kom fra de novo lipogenese og 15% fra mat [2].
NAFLD kan over tid føre til alvorlig leversykdom og det øker risikoen for leverkreft.
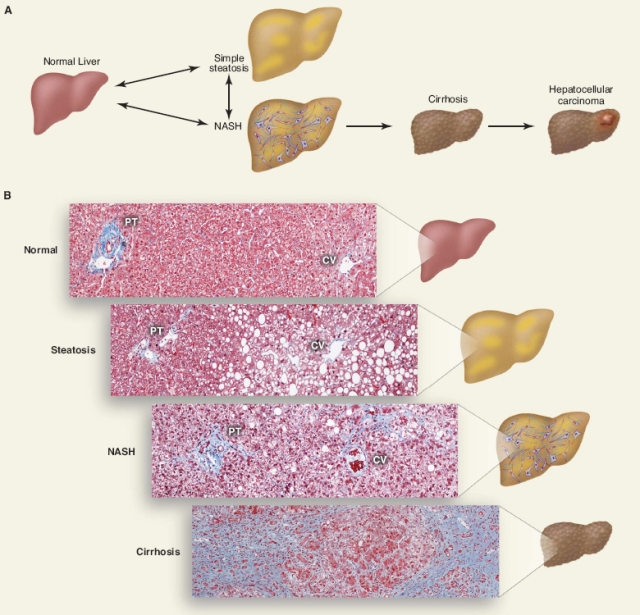 |
| Bilde fra [1]. NASH=NonAlcoholic SteatoHepatitis |
Spørsmålet er hvorfor det er så mye inflammasjon. En teori sier at når fettvevet vokser raskt, fordi det lagrer mye energi, vil det stresse deler av cellene (endoplasmatisk retikulum). Dette stresset gjør at fettvevet sender ut inflammasjonsstoffer (bl.a. c-Jun N-terminal kinase) noe som gjør at hvite blodlegemer (makrofager) inntar fettvevet som svar på stressreaksjonen. Et høyt antall hvite blodceller i fettvevet er vanlig ved overvekt. Anthony Ferrante hevder at 5% av fettvevet hos tynne er hvite blodceller (makrofager) mens tallet kommer nær 50% hos overvektige [3]. Endoplasmatisk retikulum stress skjer også i leveren og kan der hindre at leveren får sendt ut triglyserider [4].
I kombinasjon med denne innstrømmingen av hvite blodlegemer i fettvevet ser man også at fettceller dør. Har man et fettvev som lett utvider seg og danner nye fettceller er man beskyttet mot insulinresistens. Mange overvektige, også blant dem med stor overvekt, blir ikke insulinresistente og man har også laget dyremodeller som lett legger på seg som ikke blir insulinresistente. Som jeg nevnte i forrige post, vil både mennesker og dyr med lipodystrofier, som ikke kan lagre fett normalt, få insulinresistens. Dette tyder på at fettvevet kan bli dysfunksjonelt når det når en individuell grense for utvidning, en grense som påvirkes av både arv og miljø.
Et annet aspekt ved inflammasjon er at et høyt inntak av karbohydrater vil føre til høye nivåer av reaktive oksygenarter (ROS). Karbohydratrestriksjon, eller ketogene dietter, reduserer nivået av disse hos både mennesker og dyr. En av årsakene til høye ROS-nivåer er celleskader som følge av høyt blodsukker. Høye nivåer av ROS kan også komme av stort press på mitokondriene til å forbrenne frie fettsyrer.
Mitokondrienes evne til å forbrenne fett er også sentralt ved insulinresistens. Nivået av frie fettsyrer blir høyt fordi det skilles ut mer i blod enn det som forbrennes. Hvis vi øker forbrenningen av fett bedrer vi sykdomstilstanden og livsstilsbehandling av metabolsk syndrom handler mye om å øke fettforbrenningen.
Mange som jobber med ernæring tror feilaktig at insulinresistens kommer av et høy inntak av fett. I deres hoder er fettinntak årsaken til overvekt, hjerte- og karsykdom og alle følgesykdommene. En av grunnene til at det skyldes på fett er at man i studier har sett at høyt inntak av fett fører til insulinresistens. Disse studiene blir dessverre ofte misforstått.
Et eksempel på en slik studie er en fra 2001 [5]. Disse forskerne satte friske menn til å spise tre ulike kosthold ved forskjellige anledninger og målte insulinfølsomheten etter hvert kosthold. Kostholdene hadde likt energi- og protein innhold. Fett og karbohydrater var enten: 0% fett 85% og karbohydrater, 41% fett og 44karbohydrat, eller 83% fett og 2% karbohydrat. Forskerne fant at etter høyt fettinntak reagerte leveren mindre på insulin, d.v.s. den produserte mer karbohydrater enn etter de andre kostholdene. Det stemmer riktig nok at et av problemene hos dem som får høyt blodsukker er at leveren ikke reduserer blodsukkerproduksjonen slik den skal når den blir utsatt for insulin. Men dette problemet skjer hos dem som inntar mye karbohydrater og som samtidig har mye sukker i blodet fra maten.
Et høyt blodsukkernivå er skadelig, men et lavt blodsukkernivå kan være langt farligere og spesielt for hjernen. Det er derfor viktig, når man ikke spiser karbohydrater (2%), at leveren fortsetter å produsere glukose slik at blodsukkeret ikke blir farlig lavt. Det er dette som skjer når man spiser mye fett. Dette er dog en positiv og naturlig tilpassning. Fortsetter man med høyt fettinntak, får man et lavt og naturlig blodsukker samtidig som man går ned i vekt og fett i lever, bukspyttkjertel og andre organer brukes som energi med påfølgende forbedret insulinfølsomhet i disse organene.
Forskerne bak den overnevnte studien virket overrasket over hva dette funnet betyr med tanke på diabetes og skrev:
“Remarkably, in the context of diabetes risk, 2 aspects of glucose homeostasis actually improved after consumption of the HFLC [High Fat Low Carb] diet: decreased basal endogenous glucose production and improved insulin-stimulated nonoxidative glucose disposal.”
Selv om det kan virke som om den utløsende årsaken til insulinresistens (først og fremst i lever) er et fettvev som er insulinresistent og gir fra seg for mye frie fettsyrer, kan dette bildet også være en forenkling. For vi har to typer fettvev som oppfører seg forskjellig. Visceralt fett er det fettet som ligger rundt organene og dette fettvevet sender, i motsetning til underhudsfett, fettsyrer direkte til lever. Dette er årsaken til at bukfedme er en langt større risiko for sykdom enn generell fedme fordelt over kroppen. Slik sett kan det være nok at det viscerale fettvevet er insulinresistent. Både inflammasjon og stress ser ut til å øke mengden visceralt fett, og en fortrinnsvis lagring av fett rundt magen er et klassisk stress-symptom [6].
Enkelte typer lipodystrofier gjør at man ikke lagrer fett i underhudsfettet. Man blir da insulinresistent, får fettlever og en stor fettlagring i det viscerale fettet. Bildet under viser en slik person. Det gule er viceralt fett som har samlet seg rundt organene og det røde er underhudsfett.
 |
| Fra Huang-Doran et al 2010 [7] |
Å finne årsaken til insulinresistens er en runddans der fettansamlinger, redusert cellefunksjon og inflammasjon går hånd i hånd og det er vanskelig å vite hva som kommer først. Men selv om vi ikke forstår alle mekanismene ennå, kan vi likevel si mye om hvilke behandlinger som virker best. Mer om dette i neste post.
Referanser
1. Cohen JC, Horton JD, Hobbs HH: Human fatty liver disease: old questions and new insights. Science 2011, 332: 1519-1523.
2. Donnelly KL, Smith CI, Schwarzenberg SJ, Jessurun J, Boldt MD, Parks EJ: Sources of fatty acids stored in liver and secreted via lipoproteins in patients with nonalcoholic fatty liver disease. J Clin Invest 2005, 115: 1343-1351.
3. Taubes G: Insulin resistance. Prosperity’s plague. Science 2009, 325: 256-260.
4. Ota T, Gayet C, Ginsberg HN: Inhibition of apolipoprotein B100 secretion by lipid-induced hepatic endoplasmic reticulum stress in rodents. J Clin Invest 2008, 118: 316-332.
5. Bisschop PH, de Metz J, Ackermans MT, Endert E, Pijl H, Kuipers F, Meijer AJ, Sauerwein HP, Romijn JA: Dietary fat content alters insulin-mediated glucose metabolism in healthy men. Am J Clin Nutr 2001, 73: 554-559.
6. Adam TC, Epel ES: Stress, eating and the reward system. Physiol Behav 2007, 91: 449-458.
7. Huang-Doran I, Sleigh A, Rochford JJ, O’Rahilly S, Savage DB: Lipodystrophy: metabolic insights from a rare disorder. J Endocrinol 2010, 207: 245-255.
Legg igjen en kommentar